陈亮课题组在《自然·实验室指南》发表方法学论文
新闻网讯(通讯员韩玉芹)近日, Nature Protocols (《自然·实验室指南》,IF=12.423)在线发表生命科学学院陈亮研究员与美国加州大学圣地亚哥分校付向东教授的方法学论文,两人为该文共同通讯作者。
论文题为“R-ChIPfor Genome-wide Mapping of R-loops by Using Catalytically Inactive RNASEH1”(《利用RNASEH1的酶活突变体在全基因组捕获R-loop的新方法—R-ChIP》),该工作获得武汉大学引进人才启动经费的资助。
当由转录产生的RNA与模板DNA通过碱基互补配对形成杂合链时,另外一条非模板DNA链将处于单链状态,由此形成的三链核酸结构称为R-loop。R-loop广泛存在于细菌、真菌、植物与动物的基因组中,在基因转录、DNA复制、表观遗传修饰以及DNA损伤修复等过程中都具有重要作用,并与许多重大疾病的发生和发展密切相关,是近年来分子生物学的一个新研究热点。
R-loop研究非常依赖能够准确定位与定量R-loop结构的检测技术。此前广泛应用的DRIP-seq技术主要利用识别RNA/DNA杂合链的单克隆抗体S9.6对R-loop进行体外富集,并进行建库测序。该方法可以在全基因组水平对R-loop信号进行检测,但也存在若干技术问题,包括检测信号的分辨率有限和S9.6抗体的特异性不足。此外,体外富集的DRIP-seq信号能否真实反映细胞内R-loop的水平仍存在争议。解决这些问题并进一步推动R-loop研究的进展亟待独立新技术的开发。
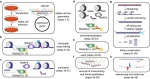
本文报道的新技术R-ChIP通过在细胞中表达RNASEH1突变体(RNASEH1为特异性切割R-loop的内切酶,经突变改造后失去催化功能,但其R-loop结合活性被保留),可特异性识别体内形成的R-loop,通过富集和文库的建立与测序,即可绘制细胞内R-loop的全基因组图谱。
该方法具有三个特点:内源性,直接在细胞体内捕获R-loop;高分辨率,检测精度在200个碱基左右;高特异性,研究者可以使用RNASEH1催化/结合位点双突变体的R-ChIP数据做为阴性对照,进一步提高R-loop识别信号的特异性。陈亮在此前的工作中利用R-ChIP技术对R-loop的动态变化进行监测,发现RNA聚合酶的停滞是促进R-loop形成的重要原因,并发现转录区域DNA的GC分布以及非模板链形成的二级结构对R-loop的形成具有重要影响(Chen et al, 2017, Mol Cell)。在R-loop与重大疾病关系的研究中,陈亮运用R-ChIP技术发现在骨髓增生异常综合症(MDS)中,多种剪接因子的突变均造成造血干细胞R-loop水平的紊乱,从而影响基因组的稳定性与细胞功能维持(Chen et al, 2018, Mol Cell),提示R-loop异常可能是MDS疾病发生的重要机制,为MDS与白血病的研究和治疗提供了全新视角。
论文链接: https://www.nature.com/articles/s41596-019-0154-6
(编辑:肖珊)